テクネチウムのモル質量は 95 43 です。 元素および化合物のモル質量
ここで、純粋に物理的な余談をしなければなりません。そうしないと、なぜセグレがこのモリブデン片をそれほど必要としたのかが明確になりません。 今日の標準から見て低出力である世界初のサイクロトロンの偏向板の「歯」はモリブデンで作られていました。 サイクロトロンは、荷電粒子、たとえば重水素、重水素の原子核である重陽子の動きを加速する機械です。 粒子は高周波電場によってらせん状に加速され、回転するごとに強力になりますが、サイクロトロンで働いたことのある人なら誰でも、ターゲットを真空中に直接設置した場合に実験を行うことがいかに難しいかをよく知っています。サイクロトロンのチャンバー。 必要なすべての機器を配置できる特別なチャンバーで、抽出されたビームを作業する方がはるかに便利です。 しかし、サイクロトロンからビームを取り出すのは決して簡単ではありません。 これは、高電圧が印加される特別な偏向板を使用して行われます。 プレートはすでに加速された粒子ビームの経路に設置され、粒子ビームを目的の方向に偏向します。 最適なプレート構成を計算することは科学です。 しかし、サイクロトロン プレートは最高の精度で製造および設置されているにもかかわらず、その前部、つまり「歯」が加速された粒子の約半分を吸収します。 当然のことながら、「歯」は衝撃により熱くなるため、現在は耐火性モリブデンで作られています。
しかし、歯の材質に吸収された粒子がその中で核反応を引き起こすのも当然であり、物理学者にとって多かれ少なかれ興味深いものです。 セグレ氏は、モリブデンでは非常に興味深い核反応が可能であり、その結果、これまで何度も発見され、常に「閉鎖」されていた元素番号 43 (テクネチウム) がついに真に発見される可能性があると信じていました。
イルメニアからマズリアへ
元素No.43は長い間探し求められてきました。 そして長い間。 彼らはそれを鉱石や鉱物、主にマンガンから探しました。 メンデレーエフは、表のこの要素の空のセルを残し、それをエカマンガンと呼びました。 しかし、この細胞の最初の候補者は、周期律が発見される前から現れていました。 1846 年に、マンガンの類似体であるイルメニウムが鉱物イルメナイトから分離されたと言われています。 イルメニウムが「閉鎖」された後、デイビー、ルシウム、ニッポニウムという新たな候補者が現れました。 しかし、それらは「偽りの要素」であることも判明しました。 周期表の 43 番目のセルは空のままでした。
私たちの世紀の20年代、エカマンガンとドウィマンガン(ekaは「1」、dvi - 「2」を意味します)、つまり元素番号43と75の問題が、優秀な実験者の配偶者アイダとウォルター・ノダックによって取り上げられました。 グループや時代を超えて元素の性質の変化のパターンを追跡した結果、マンガンとそのエカ類似体およびジ類似体の類似性はこれまで考えられていたよりもはるかに低く、マンガンとその類似体は以前に考えられていたよりもはるかに小さいという、一見扇動的だが本質的には正しい考えに到達した。これらの元素をマンガン鉱石ではなく、粗製のプラチナやモリブデン鉱石から探す方が合理的です。
ノダック夫妻の実験は何か月間も続けられた。 1925年に、彼らは新しい元素であるマスリウム(元素番号43)とレニウム(元素番号75)の発見を発表しました。 新しい元素の記号は周期表の空のセルを占めていましたが、後に、2 つの発見のうち 1 つだけが実際に行われたことが判明しました。 アイダとウォルター・ノダックは、元素番号 43 のテクネチウムと何の共通点も持たない不純物をマスリウムと間違えました。
記号 Ma は 10 年以上も元素表に載っていましたが、1934 年に元素番号 43 はマンガン、プラチナ、その他の鉱石には見つからないと主張する 2 つの理論的研究が発表されました。 私たちは、ドイツの物理学者G.マタウフとソ連の化学者S.A.シュチュカレフによってほぼ同時に策定された禁止規則について話しています。
テクネチウム - 「禁じられた」元素と核反応
同位体の発見後すぐに、等圧体の存在が確立されました。 等圧線と等圧線は、デカンタと伯爵夫人と同じくらい遠い概念であることに注意してください。 アイソバーは、異なる元素に属する同じ質量数の原子です。 いくつかの等圧線の例: 93 Zr、93 Nb、93 Mo。
マタウチ・シュチュカレフ則の意味は、奇数の安定同位体は安定同圧線を持つことができないということです。 したがって、元素番号 41 の同位体であるニオブ 93 が安定であれば、隣接する元素の同位体であるジルコニウム 93 とモリブデン 93 は必然的に放射性であるはずです。 このルールは要素番号 43 を含むすべての要素に適用されます。
この元素はモリブデン (原子量 95.92) とルテニウム (原子量 101.07) の間に位置します。 したがって、この元素の同位体の質量数は 96 ~ 102 の範囲を超えてはなりません。 しかし、この範囲内の安定した「空席」はすべて埋まっています。 モリブデンには質量数 96、97、98、100 の安定同位体があり、ルテニウムには質量数 99、101、102 などの安定同位体があります。 これは、元素番号 43 が単一の非放射性同位体を持つことができないことを意味します。 しかし、このことから、地殻中にラジウム、ウラン、トリウムが存在しないということには全くなりません。
ウランとトリウムは、一部の同位体の寿命が長いため、地球上に保存されてきました。 他の放射性元素は、放射性崩壊の生成物です。 元素番号 43 は、半減期が数百万年と測定される同位体を持っている場合、またはその長寿命同位体が元素番号 90 の崩壊によって (そして非常に頻繁に) 形成される場合の 2 つの場合でのみ検出できました。そして92。
セグレ氏は前者には当てはまらなかった。元素番号 43 の長寿命同位体が存在していれば、より早く発見されていただろう。 2番目の可能性も考えられません。ほとんどのトリウムとウラン原子はアルファ粒子を放出することによって崩壊し、そのような崩壊の連鎖は原子番号82の元素である鉛の安定同位体で終わります。より軽い元素はウランとトリウムのアルファ崩壊では形成されません。
確かに、別のタイプの崩壊、つまり重い原子核がほぼ同じ質量の 2 つの断片に自発的に分裂する自発的核分裂が存在します。 ウランの自発核分裂中に、元素番号 43 の核が形成される可能性がありますが、そのような核は非常に少数です。平均すると、200 万回の自発核分裂に 1 個のウラン核が発生し、100 回のウラン核の自発核分裂イベントに 1 個のウラン核が発生します。 、要素番号 43 は 2 つだけで構成されます。 しかし、エミリオ・セグレは当時そのことを知りませんでした。 自然核分裂は、元素番号 43 の発見からわずか 2 年後に発見されました。
セグレは照射されたモリブデンの破片を海を越えて運んでいた。 しかし、その中から新しい元素が発見されるという確証はありませんでしたし、発見されるはずもありませんでした。 「賛成」と「反対」がありました。
モリブデン板の上に落ちると、高速重陽子はその厚さのかなり深くまで浸透します。 場合によっては、重陽子の 1 つがモリブデン原子の原子核と結合することがあります。 このためには、まず第一に、重陽子のエネルギーが電気的反発力に打ち勝つのに十分であることが必要です。 これは、サイクロトロンが重陽子を約 15,000 km/秒の速度まで加速する必要があることを意味します。 重陽子核とモリブデン核の融合によって形成される複合核は不安定です。 余分なエネルギーを取り除く必要があります。 したがって、合体が起こるとすぐに、そのような原子核から中性子が飛び出し、モリブデン原子の元の原子核は元素番号43の原子の原子核に変わります。
天然モリブデンは 6 つの同位体で構成されており、原則として、照射されたモリブデン片には新しい元素の 6 つの同位体の原子が含まれる可能性があることを意味します。 一部の同位体は寿命が短く、特に照射後 1 か月以上経過した場合、化学的にとらえにくい場合があるため、これは重要です。 しかし、新元素の他の同位体は「生き残る」可能性がある。 これらはセグレが見つけたいと思っていたものです。 実際、プロのすべてはそこで終わりました。 「反対」の方がはるかに多かったです。
元素番号 43 の同位体の半減期についての無知は研究者にとって不利であり、元素番号 43 の同位体が 1 か月以上存在しないという事態も起こり得ます。 モリブデン、ニオブ、その他いくつかの元素の放射性同位体が形成される「付随」核反応も、研究者らにとって不利に働いた。
放射性多成分混合物から最小限の未知元素を単離することは非常に困難です。 しかし、これはまさにセグレと彼の数人のアシスタントがしなければならなかったことでした。
研究は 1937 年 1 月 30 日に始まりました。まず、サイクロトロン内にあったモリブデンが海を渡って放出した粒子を調べました。 それはベータ粒子、つまり高速核電子を放出しました。 約200mgの照射モリブデンを王水に溶解すると、その溶液のベータ放射能は数十グラムのウランのベータ放射能とほぼ同じであった。
これまで知られていなかった活動が発見されましたが、「犯人」が誰であるかはまだ判明していません。 まず、モリブデンに含まれる不純物から形成された放射性リン 32 が溶液から化学的に分離されました。 次に、同じ解決策を周期表の行と列ごとに「反対検査」しました。 未知の活性の担体は、ニオブ、ジルコニウム、レニウム、ルテニウムの同位体、そして最終的にはモリブデンそのものである可能性があります。 これらの元素が放出された電子に関与していないことを証明することによってのみ、元素番号 43 の発見について語ることができます。
この研究の基礎として 2 つの方法が使用されました。1 つは論理的排除法で、もう 1 つは「キャリア」法で、この元素または別の元素の化合物が化学反応で類似したものである場合に、化学者が混合物を分離するために広く使用しています。プロパティ。 そして、キャリア物質が混合物から除去されると、そこから「関連する」原子が運び去られます。
まず第一に、ニオブは除外されました。 溶液を蒸発させ、得られた沈殿を今度は水酸化カリウムに再度溶解した。 一部の元素は未溶解部分に残りましたが、未知の活性が溶解しました。 そして、安定したニオブが放射性ニオブを「取り除く」ために、ニオブ酸カリウムがそれに加えられました。 もちろん、それが溶液中に存在する場合。 ニオブは消滅しましたが、活性は残っています。 ジルコニウムも同様の試験を受けました。 しかし、ジルコニウム部分も不活性であることが判明した。 その後、硫化モリブデンが沈殿しましたが、活性はまだ溶液中に残っていました。
この後、最も困難な部分が始まりました。未知の活性とレニウムを分離する必要がありました。 結局のところ、「歯」の材料に含まれる不純物は、リン 32 だけでなく、レニウムの放射性同位体にも変化する可能性があります。 未知の活性を溶液から引き出したのはレニウム化合物だったため、これはさらに可能性が高いように思われました。 そして、ノダック夫妻が発見したように、元素番号 43 はマンガンや他の元素よりもレニウムに似ているはずです。 他のすべての「候補」はすでに拒否されていたため、未知の活性をレニウムから分離することは、新しい元素を見つけることを意味しました。
エミリオ・セグレと彼の最も近いアシスタントであるカルロ・ペリエはこれを行うことができました。 彼らは、塩酸溶液 (0.4 ~ 5 規定) 中で、硫化水素を溶液に通すと、活性が未知の担体が沈殿することを発見しました。 しかし、レニウムも同時に抜け落ちます。 より濃縮された溶液(10規定)から沈殿が実行される場合、レニウムは完全に沈殿し、元素は部分的にのみ未知の活性を持ちます。
最後に、ペリエは制御の目的で、ルテニウムとマンガンから未知の活性の担体を分離する実験を実施しました。 そして、ベータ粒子はテクネチウム(ギリシャ語の「人工」に由来)と呼ばれる新元素の原子核からのみ放出できることが明らかになりました。
これらの実験は 1937 年 6 月に完了しました。このようにして、最初の化学的な「恐竜」が再現されました。かつて自然界に存在していましたが、放射性崩壊の結果完全に「絶滅」した元素です。
その後、ウランの自然核分裂の結果として形成された極少量のテクネチウムが地中で発見されました。 ちなみに、同じことがネプツニウムとプルトニウムでも起こりました。最初はこの元素は人工的に入手され、研究後に初めて自然界で見つけることができました。
現在、テクネチウムは原子炉内のウラン 35 の核分裂破片から得られます。。 確かに、それを断片の塊から分離するのは簡単ではありません。 破片1キログラムあたり、元素番号43は約10グラムあります。これは主に同位体テクネチウム99であり、その半減期は21万2千年です。 原子炉内のテクネチウムの蓄積のおかげで、この元素の特性を決定し、純粋な形で取得し、かなりの数のその化合物を研究することができました。 これらの中で、テクネチウムは価数 2+、3+、および 7+ を示します。 レニウムと同様に、テクネチウムは重金属 (密度 11.5 g/cm3) であり、耐火性 (融点 2140°C) で、耐薬品性があります。
それでも テクネチウム- 最も希少で最も高価な金属(金よりもはるかに高価)の 1 つであり、すでに実用的な利点をもたらしています。
腐食が人類に与える被害は甚大です。 平均すると、10 基ごとの高炉が腐食の「コストをカバー」するために稼動しています。 金属の腐食を遅らせる阻害物質があります。 最良の阻害剤は過テクン酸塩、つまりテクニン酸 HTcO 4 の塩であることが判明しました。 TcO 4 の1万分の1モルの添加 -
最も重要な構造材料である鉄および低炭素鋼の腐食を防ぎます。
過テクネチウムの広範な使用は、テクネチウムの放射能とその高コストという 2 つの状況によって妨げられています。 レニウムとマンガンの同様の化合物は腐食を防ぐことができないため、これは特に残念です。
元素番号 43 には、もう 1 つのユニークな特性があります。 この金属が超伝導体になる温度 (11.2 K) は、他の純粋な金属よりも高くなります。 確かに、この数値は、純度があまり高くないサンプル (わずか 99.9%) で得られたものです。 それにもかかわらず、テクネチウムと他の金属との合金が理想的な超電導体であることが判明すると信じる理由があります。 (一般に、合金における超電導状態への転移温度は、市販の純粋な金属よりも高くなります。)
テクネチウムはそれほど実用的ではありませんが、天文学者にとって有益な目的を果たしてきました。 テクネチウムは、アンドロメダ星などのいくつかの星でスペクトル法によって発見されました。 スペクトルから判断すると、元素番号 43 は、ジルコニウム、ニオブ、モリブデン、ルテニウムと同じくらい広く分布しています。 これは、宇宙の元素の合成が現在も続いていることを意味します。
テクネチウム(緯度テクネチウム)、Te、メンデレーエフ周期表のVII族の放射性化学元素、原子番号43、原子質量98、9062。 金属、可鍛性と延性。
原子番号 43 の元素の存在は、D. I. メンデレーエフによって予測されました。 T.は1937年にイタリアの科学者E. セグレモリブデン原子核に重陽子を照射中のK. Perrier。 ギリシャ語からその名前が付けられました。 technet o s - 人工的。
T.には安定同位体がありません。 放射性同位体 (約 20) のうち、実用的に重要なのは 99 Tc と 99m tc の 2 つで、それぞれ半減期があります。 T1/2 = 2,12 ? 10 5 年と t1/2 = 6,04 h.自然界では、この元素は少量 - 10 -10 存在します。 G 1で Tウランタール。
物理的及び化学的性質 。 粉末状の金属 T. は灰色です (re、mo、pt を彷彿とさせます)。 コンパクトな金属(溶融金属インゴット、フォイル、ワイヤー)シルバーグレー。 結晶状態の T. は最密充填の六方格子を持っています ( あ= 2.735 å、c = 4.391 å); 薄い層(150 Å未満) - 立方体の面心格子( a = 3.68 ± 0.0005 å); T.密度(六方格子あり) 11.487 g/cm3、tpl 2200±50℃; キップ 4700℃; 電気抵抗率 69 10 -6 おお? cm(100℃); 超伝導状態への転移温度 Tc 8.24 K.T. 常磁性。 25°C での磁化率は 2.7 10 -4 です。 . Tc 4 原子の外電子殻の構成 d 5 5 s 2 ; 原子半径 1.358 å; イオン半径 Tc 7+ 0.56 å.
化学的性質の点では、tc は mn、特に re に近く、化合物では -1 から +7 の酸化状態を示します。 酸化状態 +7 の Tc 化合物は最も安定であり、よく研究されています。 T.またはその化合物が酸素と相互作用すると、酸化物tc 2 o 7およびtco 2が形成され、塩素およびフッ素のハロゲン化物TcX 6、TcX 5、TcX 4、例えばTcO 3 X(ここで、X はハロゲンです)、硫黄 - 硫化物 tc 2 s 7 および tcs 2。 T. はまた、テクネチン酸 htco 4 およびその過テクン酸塩 mtco 4 (M は金属)、カルボニル、錯体、および有機金属化合物を形成します。 一連の電圧では、T. は水素の右側にあります。 どの濃度の塩酸とも反応しませんが、硝酸、硫酸、王水、過酸化水素、臭素水には容易に溶解します。
レシート。 T.の主な発生源は原子力産業からの廃棄物です。 235 u を分割したときの 99 tc の収率は約 6% です。 T.は、有機溶媒による抽出、イオン交換法、および難溶性誘導体の沈殿によって、過テクン酸塩、酸化物、および硫化物の形態の核分裂生成物の混合物から抽出されます。 この金属は、600 ~ 1000 °C での水素 nh 4 tco 4、tco 2、tc 2 s 7 による還元、または電気分解によって得られます。
応用。 T.は技術的に有望な金属です。 触媒、高温および超伝導材料としての用途が見出されます。 T. 化合物は効果的な腐食防止剤です。 99m tcはg線源として医療で使用されています . T. は放射線の危険性があるため、作業には特別な密閉装置が必要です .
点灯:コテゴフ K.V.、パブロフ O.N.、シュベドフ V.P.、テクネティウス、M.、1965 年。 原子力産業廃棄物からの金属およびその化合物の形での Tc 99 の入手、著書: Production of Isotopes、M.、1973。
意味
テクネチウム周期表の第 2 (B) 亜族の VII 族の第 5 周期に位置します。
要素を参照します d-家族。 金属。 指定 - Tc. シリアル番号 - 43。相対原子量 - 99 amu。
テクネチウム原子の電子構造
テクネチウム原子は正に帯電した原子核 (+43) で構成され、その中に 43 個の陽子と 56 個の中性子があり、43 個の電子が 5 つの軌道を動き回ります。
図1。 テクネチウム原子の概略構造。
軌道間の電子の分布は次のとおりです。
43Tc) 2) 8) 18) 13) 2 ;
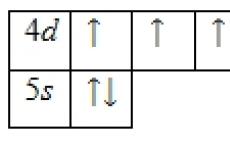
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 5 5s 2 .
テクネチウム原子の外側のエネルギー準位には、価電子である 7 つの電子が含まれています。 基底状態のエネルギー図は次の形式になります。

テクネチウム原子の価電子は、4 つの量子数のセットによって特徴付けることができます。 n(主量子)、 私(軌道)、 ミリリットル(磁気) と s(スピン):
|
サブレベル |
||||
問題解決の例
例 1
| エクササイズ | 第 4 周期の元素、クロムとセレンのどちらがより顕著な金属的性質を持っていますか? 電子式を書き留めます。 |
| 答え | クロムとセレンの基底状態の電子配置を書き留めてみましょう。 24クロム1 s 2 2s 2 2p 6 3s 2 3p 6 3 d 5 4 s 1 ; 34 セ 1 s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4 s 2 4 p 4 . 金属特性は、クロムよりもセレンの方が顕著です。 この声明の真実性は、周期法則を使用して証明できます。周期法則によれば、グループ内で上から下に移動すると、元素の金属的性質は増加し、非金属的性質は減少します。これは、次のような事実によるものです。原子内のグループを下に移動すると、原子内の電子層の数が増加し、その結果、価電子がコアに保持される力が弱まります。 |
テクネチウム(緯度テクネチウム)、Tc、メンデレーエフ周期表のVII族の放射性化学元素、原子番号43、原子質量98、9062。 金属、可鍛性と延性。
テクネチウムには安定同位体がありません。 放射性同位体 (約 20) のうち、実用的に重要なのは 99 Tc と 99m Tc の 2 つで、それぞれ半減期があります。 T1/2= 2.12 × 10 5 年および T1/2 = 6,04 h.自然界では、この元素は少量 - 10 -10 存在します。 G 1で Tウランタール。
物理的及び化学的性質。
粉末状のテクネチウム金属は灰色です (Re、Mo、Pt を彷彿とさせます)。 コンパクトな金属(溶融金属インゴット、フォイル、ワイヤー)シルバーグレー。 結晶状態のテクネチウムは最密六方格子 ( あ = 2,735
、 с = 4.391); 薄い層 (150 未満) - 立方体の面心格子 ( a = 3.68? 0.0005); T.密度(六方格子あり) 11.487 g/cm3、 tpl 2200? 50℃; キップ 4700℃; 電気抵抗率 69 * 10 -6 オーム×センチメートル(100℃); 超伝導状態への転移温度 Tc 8.24 K。テクネチウムは常磁性です。 25 ℃での磁化率は 2.7 * 10 -4 です。 . Tc 4 原子の外電子殻の構成 d 5 5s 2 ; 原子半径1.358。 イオン半径 Tc 7+ 0.56。化学的性質によると Tc は Mn、特に Re に近く、化合物中では -1 から +7 までの酸化状態を示します。 酸化状態 +7 の Tc 化合物は最も安定であり、よく研究されています。 テクネチウムまたはその化合物が酸素と相互作用すると、酸化物 Tc 2 O 7 および TcO 2 が形成され、塩素およびフッ素のハロゲン化物 TcX 6、TcX 5、TcX 4 と、オキシハロゲン化物の形成が可能です。たとえば、TcO 3 X (ここで、 X はハロゲンです)、硫黄 - 硫化物 Tc 2 S 7 および TcS 2。 テクネチウムは、テクネチウム酸 HTcO 4 およびその過テクン酸塩 MeTcO 4 (Me は金属)、カルボニル、錯体および有機金属化合物も形成します。 電圧系列では、テクネチウムは水素の右側にあります。 どの濃度の塩酸とも反応しませんが、硝酸、硫酸、王水、過酸化水素、臭素水には容易に溶解します。
レシート。
テクネチウムの主な供給源は原子力産業からの廃棄物です。 235 U の核分裂からの 99 Tc の収率は約 6% です。 過テクン酸塩、酸化物、硫化物の形態のテクネチウムは、有機溶媒による抽出、イオン交換法、および難溶性誘導体の沈殿によって核分裂生成物の混合物から抽出されます。 この金属は、600~1000℃での水素によるNH 4 TcO 4 、TcO 2 、Tc 2 S 7 の還元によって、または電気分解によって得られる。
応用。
テクネチウムは技術分野で有望な金属です。 触媒、高温および超伝導材料としての用途が見出されます。 テクネチウム化合物。 - 効果的な腐食防止剤。 99m Tc は医療において g 線源として使用されます。 . テクネチウムは放射線の危険性があり、それを扱うには特別な密閉された装置が必要です。
発見の歴史。
1846 年に遡ると、ロシアで働いていた化学者で鉱物学者の R. ハーマンは、ウラルのイルメン山脈でこれまで知られていなかった鉱物を発見し、これをイトロイルメナイトと名付けました。 科学者は自分の栄光に満足せず、鉱物に含まれていると信じていた新しい化学元素をそこから単離しようとしました。 しかし、ドイツの有名な化学者 G. ローズは、イルメニウムを開く前にそれを「閉じて」、ハーマンの研究の誤りを証明しました。
四半世紀後、イルメニウムは再び化学の最前線に現れました。イルメニウムは、周期表の43位の空いた場所を占めるはずだった「エカマンガン」の役割の候補として記憶されました。イルメニウムの評判はG.ローズの著作によって大きく「汚され」、原子量を含むその性質の多くが元素番号43に非常に適していたにもかかわらず、D.I.メンデレーエフはそれを自分の表に登録しなかった。 さらなる研究により、最終的に科学界は次のことを確信しました。 , イルメニウムが化学の歴史に残ることができるのは、多くの偽元素のうちの 1 つの悲しい栄光によってのみであるということです。
聖地は決して空ではないため、その占有権を主張する人々が次々と現れた。 デイビー、ルシウム、ニッポニウム - 彼らは皆、生まれる間もなくシャボン玉のようにはじけました。
しかし 1925 年、ドイツの科学者カップル、アイダとウォルター ノダックは、マスリウム (第 43 位) とレニウム (第 75 位) という 2 つの新しい元素を発見したというメッセージを発表しました。 運命はレニウスにとって有利であることが判明しました。彼はすぐに正当化され、すぐに彼のために用意された住居を占領しました。 しかし、運命はマスリウムに背を向けました。発見者も他の科学者も、この元素の発見を科学的に確認することができませんでした。 確かに、アイダ・ノダックは、「間もなく、レニウムのようなマスリウムが店頭で買えるようになるだろう」と述べたが、ご存知のとおり、化学者たちはその言葉を信じておらず、ノダック夫妻は他にもっと説得力のある証拠を提供できなかった。 「偽の43人」のリストにまた敗者が加わった。
この時期、一部の科学者は、メンデレーエフが予測した元素のすべて、特に元素番号 43 が自然界に存在するわけではないと信じる傾向にありました。 おそらくそれらは単に存在せず、時間を無駄にして槍を折る必要はないのでしょうか? マスリウムの発見に拒否権を発動したドイツの著名な化学者ヴィルヘルム・プラントルでさえ、この結論に達しました。
化学の妹である核物理学は、その時までにすでに強い権威を得ており、この問題を解明することを可能にしました。 この科学の法則の 1 つは (20 年代にソ連の化学者 S.A. シュチュカレフによって指摘され、最終的に 1934 年にドイツの物理学者 G. マタウフによって定式化されました) は、マタウフ・シュチュカレフ則、または禁止則と呼ばれています。
その意味は、自然界には核電荷が 1 つ異なる 2 つの安定な等圧線は存在できないということです。 言い換えれば、化学元素が安定同位体を持つ場合、表内で最も近い隣り合う化学元素が同じ質量数の安定同位体を持つことは「断固として禁止」されます。 この意味で、元素番号 43 は明らかに不運でした。その左右に隣接するモリブデンとルテニウムは、近くの「領域」にあるすべての安定空孔がそれらの同位体に属していることを確認しました。 そしてこれは、元素番号 43 が厳しい運命を背負っていることを意味しました。同位体がどれだけ多くても、それらはすべて不安定になる運命にあり、そのため望むと望まざるにかかわらず、昼夜を問わず継続的に崩壊しなければなりませんでした。
元素番号 43 はかつて地球上にかなりの量で存在していましたが、朝霧のように徐々に消滅していったと考えるのが合理的です。 では、この場合、なぜウランとトリウムは今日まで生き残ったのでしょうか? 結局のところ、それらは放射性物質でもあるので、彼らが言うように、人生の最初の日から、ゆっくりと、しかし確実に崩壊しますか? しかし、まさにここに私たちの質問に対する答えがあるのです。ウランとトリウムは、ゆっくりと、自然放射能を持つ他の元素よりもはるかにゆっくりと崩壊するという理由だけで保存されてきました(それでも、地球の存在の間、ウランは自然の貯蔵庫に埋蔵されています)一度100くらい減りました)。 アメリカの放射化学者らの計算によると、何らかの元素の不安定同位体は、その半減期が1億5000万年を超える場合に限り、「世界の創造」から現在に至るまで地殻の中で生き残る可能性があることが示された。 将来を見据えて、元素番号 43 のさまざまな同位体が得られたとき、それらの中で最も長生きしたものの半減期はわずか 250 万年強であることが判明したと言えます。最初の恐竜の地球: 結局のところ、私たちの惑星は約 45 億年間、宇宙の中で「機能」してきました。
したがって、科学者が自分の手で元素番号43に「触れたい」と思ったら、同じ手でそれを作成する必要がありました。なぜなら、自然はずっと前にそれを欠落元素のリストに含めていたからです。 しかし、科学はそのような課題を達成できるでしょうか?
そう、肩の上です。 これは 1919 年に英国の物理学者アーネスト・ラザフォードによって初めて実験的に証明されました。 彼は窒素原子の原子核に激しい砲撃を加え、絶えず崩壊するラジウム原子を兵器として、その結果生じるアルファ粒子を発射体として利用しました。 長期にわたる砲撃の結果、窒素原子の核には陽子が補充され、酸素に変わりました。
ラザフォードの実験は、科学者たちに並外れた大砲を与えました。その助けを借りて、破壊するのではなく、創造すること、つまりある物質を別の物質に変換し、新しい元素を得ることができました。
では、この方法で要素番号 43 を取得してみてはいかがでしょうか。 イタリアの若い物理学者エミリオ・セグレは、この問題の解決策に取り組みました。 30 年代初頭、彼は当時有名なエンリコ フェルミの指導の下、ローマ大学で働きました。 セグレは他の「少年たち」(フェルミが冗談めかして才能ある生徒たちと呼んだ)と一緒に、ウランの中性子照射の実験に参加し、核物理学の他の多くの問題を解決した。 しかし、この若い科学者は、パレルモ大学の物理学科長という魅力的なオファーを受けました。 彼が古都シチリアに到着したとき、彼は失望した。彼が率いることになった研究室は質素以上のもので、その外観は科学的発展にまったく貢献していなかった。
しかし、原子の秘密をより深く探求したいというセグレの願望は大きかった。 1936 年の夏、彼は海を渡り、アメリカの都市バークレーを訪れました。 ここ、カリフォルニア大学の放射線研究室では、アーネスト・ローレンスが発明した原子粒子加速器であるサイクロトロンが数年間稼働していました。 今日、この小さな装置は物理学者にとっては子供のおもちゃのように見えるでしょうが、当時、世界初のサイクロトロンは他の研究室の科学者の賞賛と羨望を呼び起こしました(1939年にE.ローレンスはその創設によりノーベル賞を受賞しました)。
タスク1。テクネチウム原子の電子式を書きなさい。 最後から 2 番目の電子層の d サブレベルには電子が何個ありますか? 元素はどの電子族に属しますか?
解決:周期表の Tc 原子の通し番号は 43 です。したがって、その殻には 43 個の電子が含まれています。 電子式では、(クレチコフスキーの規則に従って) 充填順序に従って、サブレベルの容量を考慮して、それらをサブレベルに分配します: Tc 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 5 5 秒 2. この場合、サブレベルを埋める順序は次のとおりです: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d。 最後の電子は 4d サブレベルに位置しており、テクネチウムが d 元素ファミリーに属していることを意味します。 最後から 2 番目 (4 番目) の層の d 副準位には 5 つの電子があります。
答え: 5、d.
タスク2。電子配置 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 1 を持つ元素はどれですか?
解決:
中性原子の殻内の電子の数は 49 です。したがって、その核電荷、したがってシリアル番号も 49 です。D.I. メンデレーエフの周期表では、この元素がインジウムであることがわかります。
タスク3。次の化合物のうち、最も酸性の性質が低いのはどれですか? a) HNO 3、b) H 3 PO 4、c) H 3 AsO 4、d) H 3 SbO 4。
解決:
所定の酸素含有化合物は、周期表の V 族の主要な亜族の元素の水酸化物です。 水酸化物の酸性特性は、サブグループの上から下に向かって弱くなることが知られています。 したがって、このシリーズでは、H 3 SbO 4 の酸性特性が最も顕著ではありません。
答え:H 3 SbO 4。
タスク4。BBr 3 分子内のホウ素軌道のハイブリダイゼーションのタイプを示します.
解決:
ホウ素原子と臭素原子の間の 3 つの共有結合の形成には、ホウ素原子の 1 つの s 軌道と 2 つの p 軌道が関係しており、それらの性質は異なります。 BBr 3 分子内のすべての化学結合は同等であるため、ホウ素原子はハイブリダイゼーションを起こします。 外側電子層の上記 3 つの軌道がそれに関与します。 したがって、ハイブリダイゼーションのタイプは sp 2 です。
答え:sp 2.
タスク5。周期表データを使用して、高級酸化鉛の経験式を作成します。 そのモル質量はどれくらいですか?
解決:
鉛は周期表の第 4 族に属しているため、最高の酸化状態は +4 です。 酸化物中の酸素原子の酸化状態は -2 であるため、酸化物分子には鉛原子ごとに 2 つの酸素原子が存在します。 最も高い酸化物の式は PbO 2 です。 そのモル質量を計算しましょう: 207+2・16=239。
答え: 239 g/mol。
タスク6。NH 4 I 分子にはどのような種類の化学結合がありますか?
解決:
NH 4 I 分子は NH 4 + イオンと I - イオンで構成され、それらの間にはイオン結合があります。 NH 4 + イオンでは、4 つの結合が極性共有結合であり、そのうちの 1 つはドナー - アクセプターのタイプに応じて形成されます (セクション 3.2.3 を参照)。
答え: イオン性、共有結合性、極性、ドナー-アクセプター。
タスク7。結合エネルギーの計算.
次のデータを使用して、H 2 S 分子の H-S 結合エネルギーを計算します: 2H 2 (g) + S 2 (g) = 2 H 2 S (g) – 40.30 kJ; D(H-H) 結合と D(S-S) 結合のエネルギーは、それぞれ -435.9 kJ/mol と -417.6 kJ/mol です。
解決: 2 つの H 2 S 分子の形成は、結合破壊の一連のプロセスとして表すことができます。 ひ、ひ分子内で H2そしてつながり S-S分子内で S2:
2 H-H 4 H – 2D(H-H)
S-S 2 S-D(S-S)
4H+2S 2H2S+ 4D(S-H)、
どこ D(H-H)、D(S-S)そして D(S-H) –絆形成のエネルギー H-H、S-Sそして S-Hそれぞれ。 上式の左辺と右辺を合計すると、熱化学方程式が得られます。
2H 2 (g) + S 2 (g) = 2 H 2 S (g) –2D(H-H) – D(S-S) + 4D(S-H)。
この反応の熱効果は、
Q = –2D(H-H) – D(S-S) + 4D(S-H)、どこ D(S-H)= 。
タスク8。リンク長の計算。
H 2 分子と Br 2 分子の核間距離が 0.74 の場合の HBr 分子の結合長を計算します。∙10 -10 そして2 ,28 ∙10~10メートルそれぞれ。
解決: 2 つの異なる原子間の共有結合の長さは、それらの共有結合半径の合計に等しい
l(H-Br) = r(H) + r(Br)。
次に、原子の共有結合半径は、分子内の核間距離の半分として定義されます。 H2そして BR2:
したがって、
答え: 1.51・10 -10 m。
タスク9。軌道のハイブリダイゼーションのタイプと分子の空間構造の決定。
SiF 4 分子の形成中にシリコン原子内でどのような種類の電子雲の混成が起こりますか? この分子の空間構造は何でしょうか?
解決:励起状態におけるシリコン原子の外部エネルギー準位の構造は次のとおりです。
| 3秒 | 3P | ||
| 3秒 | 3P× | 3人 | 3pz |
第 3 のエネルギー準位の電子は、シリコン原子内の化学結合の形成に関与します。s 状態には 1 つの電子、p 状態には 3 つの電子が含まれます。 SiF 4 分子が形成されると、4 つのハイブリッド電子雲 (sp 3 ハイブリッド形成) が現れます。 SiF 4 分子は空間四面体構造を持っています。
問題10。これらの元素の原子の基底状態および励起状態のグラフィカルな電子式の分析に基づく、化合物中の元素の価数の決定.
不対電子により、硫黄は基底状態と励起状態でどの価数を示すことができますか?
解決:フント則を考慮した硫黄の外部エネルギー準位の電子分布…3s 2 3p 4 は次の形式になります。
| s | p | d | |||||||
| 16S |
基底状態と 2 つの励起状態の分析から、通常状態の硫黄の価数 (スピン価数) は 2、最初の励起状態では 4、2 番目の励起状態では 6 であることがわかります。
テストタスクのオプション
オプション1
1. PSE 内の位置に基づいて、要素に関するどのような情報を知ることができますか?
2. シリアル番号 9 と 28 の元素の原子の電子式を書きます。量子セル全体にわたるこれらの原子の電子の分布を示します。 これらの元素はそれぞれどの電子族に属しますか?
オプション 2
1. 定義: 原子のイオン化エネルギー、電子親和力、電気陰性度? 期間やグループ間でそれらはどのように変化するのでしょうか?
2. シリアル番号 16 と 26 の元素の原子の電子式を書きます。これらの原子の電子を量子セル間で分配します。 これらの元素はそれぞれどの電子族に属しますか?
オプション 3
1. どの共有結合が極性と呼ばれ、どの共有結合が非極性と呼ばれますか? 共有結合の極性を定量的に測るものは何ですか?
2. 占有できる電子の最大数はいくつですか? s-, p-, d- そして f-特定のエネルギー準位の軌道? なぜ? 原子番号 31 の元素の原子の電子式を書きます。
オプション 4
1. 原子価結合 (BC) 法は、BeCl 2 分子の線形構造をどのように説明しますか?
4秒または 3D; 5秒または 4p? なぜ? 原子番号 21 の元素の原子の電子式を書きます。
オプション 5
1. どの結合をσ結合と呼び、どちらをπ結合と呼びますか?
2. 原子のどの軌道が最初に電子で満たされるか: 4Dまたは 5秒; 6秒または 5p? なぜ? 原子番号 43 の元素の原子の電子式を書きます。
オプション 6
1. 双極子モーメントとは何ですか?
2. シリアル番号 14 と 40 の元素の原子の電子式を記述します。いくつ空きますか 3D-最後の元素の原子の軌道?
オプション 7
1. イオンと呼ばれる化学結合は何ですか? その形成のメカニズムは何ですか?
2. シリアル番号 21 と 23 の元素の原子の電子式を記述します。いくつ空きますか 3D-これらの元素の原子の軌道は?
オプション 8
1. 最も広く使用されている周期表のバージョンとその理由は何ですか?
2. 無料の数 d-原子に見られる軌道 Sc、Ti、V?これらの元素の原子の電子式を書きます。
オプション 9
1. イオン結合のどのような性質が共有結合と区別されますか?
2. フントの法則を使用して、原子の最低エネルギー状態 (クロム、リン、硫黄、ゲルマニウム、ニッケル) に対応する量子セル間に電子を分配します。
2. ホウ素原子には 2 つの異なる電子状態が可能です  そして
そして  。 これらの状態は何と呼ばれますか? 最初の状態から 2 番目の状態に移行するにはどうすればよいでしょうか?
。 これらの状態は何と呼ばれますか? 最初の状態から 2 番目の状態に移行するにはどうすればよいでしょうか?
オプション 11
1. 4 つの異なるタイプの原子軌道のうち、最も複雑な式を持つのはどれですか?
2. 元素のどの原子が、指定された電子式のそれぞれに対応しますか。
A)  ;b)
;b)  ;
;
オプション 12
2. フントの法則を使用して、原子の最高エネルギー状態 (マンガン、窒素、酸素、シリコン、コバルト) に対応する量子セル間で電子を分配します。
オプション 13
1. 任意の層の p 軌道に 4 つの電子がある場合、不対スピンを持つ電子はいくつあり、それらの合計スピン数はいくつですか?
2. 元素のどの原子とその状態が次の電子式に対応するか  そして
そして  ;
;  そして
そして  ?
?
オプション 14
1. 以下の情報があれば、原子のどのような特性に名前を付けることができますか? a) 周期表内の元素のシリアル番号。 b) 期間番号。 c) 要素が配置されているグループの番号と種類?
2. 原子番号 12、25、31、34、45 の元素の電子式を使用して、原子の電子配置を書きます。
オプション 15
1. 周期表内の原子の位置に基づいて、その組成に含まれる素粒子の数をどのように決定するのでしょうか? 硫黄原子と亜鉛原子の組成に含まれる素粒子の数を決定します。
2. フントの法則を使用して、シリアル番号 26、39、49、74、52 の元素の原子の最低エネルギー状態に対応するエネルギー セルに電子を分配します。
オプション 16
1. 量子数とは何ですか? それらは軌道と電子のどのような性質を反映しているのでしょうか? 彼らはどのような価値観をとりますか? アルミニウムと銅の原子の各エネルギー準位に存在できる電子の最大数を決定します。
2. ある元素の非励起原子の構造を反映する電子式のうち、間違っているものはどれですか: a) 1 秒 2 2 秒 2 2p 5 3 秒 1 ; b) 1秒 2 2秒 2 2p 6; V) 1 秒 2 2 秒 2 2p 6 3 秒 2 3p 6 3d 4 ; G) 1秒 2 2秒 2 2p 6 3秒 2 3p 6 4秒 2; d) 1秒 2 2秒 2 2p 6 3秒 2 3d 2 ?なぜ? 元素のどの原子が正しく構成された電子式に対応しますか?
オプション 17
1. 化学結合に関するすべての現代理論の基礎を形成する原理は何ですか? イオン結合とは何ですか? どのような特性があるのでしょうか? イオン結合を持つ化合物の例を挙げてください。
2. 最初のものには 1 つの「欠陥」があることを考慮して、シリアル番号 24 と 33 の元素の原子の電子式を記述します。 4秒-電子を 3D サブレベルに。 最大スピン量はどれくらいですか? d- 最初の原子と 1 番目の原子の電子 p-第二元素の原子の電子?
オプション 18
1.電気陰性度とは何ですか? 電気陰性度はどのように変化しますか? R-原子番号が増加する周期系のグループ内の、周期内の元素? なぜ?
2. シリアル番号 32 と 42 の元素の原子の電子式を作成します。後者には 1 つの「欠陥」があることを考慮してください。 5秒-電子あたり 4D-サブレベル。 これらの元素はそれぞれどの電子族に属しますか?
オプション 19
1. 量子数はどのような値を取ることができますか? n、l、mlそして MS、原子内の電子の状態を特徴づける? マグネシウム原子の外側の電子はどのような値を取るのでしょうか?
2. 無料の数 f-軌道は、シリアル番号 61、62、91、92 の元素の原子にありますか? フントの法則を使用して、これらの元素の原子のエネルギー セル間で電子を分配します。
オプション 20
1. イオン化エネルギーとは何ですか? それはどのような単位で表されますか? 回復活動はどのように変化しますか? s- そして p-原子番号が増加する周期表のグループ内の元素? なぜ?
2. パウリの原則とは何ですか? それは原子のサブレベルにあるのではないか p7-または d12 -電子? なぜ? 原子番号 22 の元素の原子の電子式を作成し、その価電子を示します。 .
オプション 21
1. どの軌道が電子で満たされるかという規則を列挙します。 原子の電子式は何ですか? 価電子を強調して、ケイ素と鉄の電子式を書きます。
2. 一部の元素の原子の外部エネルギー準位の電子の量子数は次の値を持ちます。 n = 4; l = 0; ミリリットル= 0; MS= 。 これらの元素の原子の電子式を記述し、どれだけの原子が空いているかを判断します 3D-orbitals にはそれぞれが含まれます。
オプション 22
1. 同位体とは何ですか? 周期表のほとんどの元素には分数で表される原子質量があることをどのように説明できますか? 異なる元素の原子は同じ質量を持つことができますか? そのような原子は何と呼ばれますか?
2. 周期表における金属の位置に基づいて、次の質問に意欲的に答えてください。2 つの水酸化物のうち、塩基が強いのはどちらですか: Ba(OH) 2 または Mg(OH) 2。 Ca(OH) 2 または Fe(OH) 2; Cd(OH) 2 または Sr(OH) 2?
オプション 23
1. 電子親和力とは何ですか? それはどのような単位で表されますか? 原子番号が増加するにつれて、非金属の酸化活性は周期系の周期およびグループ内でどのように変化しますか? 対応する要素の原子構造を答えに導きます。
2. マンガンは、+2、+3、+4、+6、+7 の酸化状態を示す化合物を形成します。 これらの酸化状態に対応する酸化物と水酸化物の式を作成します。 水酸化マンガン (IV) の両性性質を証明する反応方程式を書きます。
オプション 24
1. 元素の高級酸化物および水酸化物の酸塩基特性および酸化還元特性は、核の電荷の増加に伴ってどのように変化しますか: a) 一定期間内。 b) サブグループ内。
2. 磁気量子数はいくつ、どのような値を取ることができますか? ミリリットル軌道番号で 私= 0、1、2、3? 周期表の元素は何と呼ばれていますか s-、p-、d-そして f-要素? 例を上げてください。
オプション 25
1. ハイブリダイゼーションの理論。 ドナー-アクセプター結合の形成メカニズム。 接続例
2. どれ R-周期表の第5族の元素 - リンとアンチモン - 非金属の性質はどちらがより顕著ですか? これらの元素の水素化合物のうち、より強力な還元剤はどれですか? これらの要素の原子構造を使って答えを導き出しましょう。
オプション 26
1. 塩素、硫黄、窒素、炭素の最も低い酸化状態は何ですか? なぜ? この酸化状態にあるこれらの元素を含むアルミニウム化合物の式を作成します。 対応する化合物の名前は何ですか?
2. 原子の外側の電子のエネルギー状態は、次の量子数の値によって記述されます。 n=4, 私=0, ミリリットル=0。 元素のどの原子がそのような電子を持っていますか? これらの元素の原子の電子式を記述します。 原子の電子の量子数をすべて書きます。 a) リチウム、ベリリウム、炭素。 b) 窒素、酸素、フッ素。
オプション 27
1. 金属接続。 形成の仕組みと性質。 化合物の例とその特性。
2. 周期表におけるゲルマニウムとテクネチウムの位置に基づいて、最も高い酸化状態に対応するメタゲルマン酸とオルトゲルマン酸、および酸化テクネチウムの式を作成します。 これらの化合物の式をグラフで描きます。
オプション 28
1. 第 4 周期の元素のうち、クロムとセレンのどちらがより顕著な金属的性質を持っていますか? 水素とガス状化合物を形成する元素は次のうちどれですか? クロムとセレンの原子の構造から答えを導き出しましょう。
2. ニッケル 57 同位体は、アルファ粒子が鉄 54 原子の核に衝突すると形成されます。 この核反応の方程式を立てて省略形で書きます
オプション 29
元素の原子の電子式を書き、量子数 ( n、l、ml、m S) 外側 (最後) および最後から 2 番目の電子層の電子は次のとおりです。
a) 6、0、0、+ ; 6、0、0、-; 6、1、-1、+ ;
b) 3、2、-2、+ ; 3、2、-1、+ ; 4、0、0、+ ; 4、0、0、- 。
オプション 30
1.共有結合の形成とその基本的な仮定を説明する現代の方法。 共有結合の性質。 共有結合を持つ化合物とその性質の例を示します。
2. PSE 内の位置に基づいて、シリアル番号 17 と 25 の要素を比較説明します。 これらの元素の特性の類似点と相違点の理由を説明してください。
関連情報。